
01
简 介
研发人员发现在许多癌症中,例如PDAC(导管胰腺癌)和MCC(默克细胞癌),STING(干扰素基因刺激蛋白)是被沉默掉的。当前,包括PD1/PDL1,CTLA-4抑制剂在内的一些肿瘤治疗方法在试图攻克侵袭性癌症(aggressive cancers),例如PDAC和MCC,但是都无法产生持续的治疗效果,而且还会产生耐受治疗的情况。处于免疫抑制状态的肿瘤一直是癌症治疗的难题。因此,急需探索新型治疗手段来应对此类致死性的癌症。
激活肿瘤细胞内的STING信号通路可以将“冷”肿瘤微环境转为“热”肿瘤微环境,也就是将肿瘤组织所处的免疫抑制环境转变为免疫激活环境。在本研究中,我们应用mRNA脂质纳米粒(LNP)向PDAC和MCC细胞中传递永久活性增益功能的STING-R284S突变体。本文表明,STING-R284S的mRNA-LNP传递可以探索作为一种新的治疗工具,在重启抗肿瘤免疫反应的同时,克服传统STING 激动剂的毒性和限制性,这将有望成为治疗那些缺乏STING信号通路的癌症的有效手段。

STING信号通路
STING是天然免疫反应和抗肿瘤反应中非常重要的调控因子。经典的STING信号通路可以识别死细胞、肿瘤细胞以及病原体释放的dsDNA,线粒体DNA。这些dsDNA会被cGAS(环化GMP-AMP合成酶)识别,同时合成能够结合并且激活STING的2‘-3’cGAMP。在受到病原体相关模式分子(PAMPs)或者损伤相关的模式分子(DAMPs)刺激后,STING激活I型或者III型干扰素(IFNs)和促炎细胞因子的转录,起始天然免疫反应。在癌症细胞中,经常存在大量的损伤DNA。这些损伤DNA会刺激产生依赖STING信号通路诱导的IFNs和抗肿瘤细胞因子/趋化因子(CXCL10和CCL5)。IFNs会刺激抗肿瘤T细胞的增值、对肿瘤组织侵润渗透以及直接杀伤,而CXCL10和CCL5对于募集肿瘤反应活性的T细胞具有非常重要的作用。
因此,激活STING信号通路被证明是一种转变肿瘤微环境的非常有前景的治疗手段,能够把免疫抑制状态的“冷”肿瘤微环境转变为免疫激活状态的“热”肿瘤微环境
“冷”肿瘤
肿瘤免疫抑制一直是癌症免疫治疗的大难题,给许多恶性肿瘤的临床治疗带来巨大挑战。98%的胰腺癌患者对于PD-1/PD-L1免疫检查点阻断疗法是耐受的。几乎没有任何有效的治疗手段来对付晚期胰腺癌。胰腺癌细胞会处于一种高度免疫抑制的肿瘤微环境,从而抑制免疫系统的攻击和抵抗免疫疗法,因此将这种类型的肿瘤划归为不具有免疫原性的“冷肿瘤”。一般来说,能够侵润肿瘤组织的CD8+毒性T细胞和病人的存活能力直接相关。然而,大多数胰腺癌患者的肿瘤微环境中缺乏具有侵润能力的效应CD8+T细胞。研发人员发现,在许多癌症中,例如导管胰腺癌(PDAC)和合默克细胞癌(MCC)STING被沉默或者表达下调。
02
结果与讨论
研究发现,STING在MCC和其他几种癌细胞中没有表达,包括许多PDAC细胞系。首先分析了几个PDAC细胞系和患者病变中的STING蛋白水平(图1)。
从细胞系分析中可以发现,与原代人真皮成纤维细胞(HDF)相比,STING蛋白在AsPC-1、PANC-1和Capan-1细胞中稀少,在MIA PaCa-2中几乎检测不到。相反,在所有受试细胞系中都能清楚地检测到周期性GMP-AMP合成酶(cGAS)的水平,cGAS是STING的上游激活剂(图1A)。

图1:在PDAC中STING被下调。(A) 使用指示抗体对PDAC细胞和原代HDF细胞的全细胞裂解物进行免疫印迹。GAPDH用作加载控制。(B)PDAC病变进行STING(绿色)和CK19(红色)染色,并用DAPI复染。显示了来自7名不同患者的胰腺病变的染色结果。
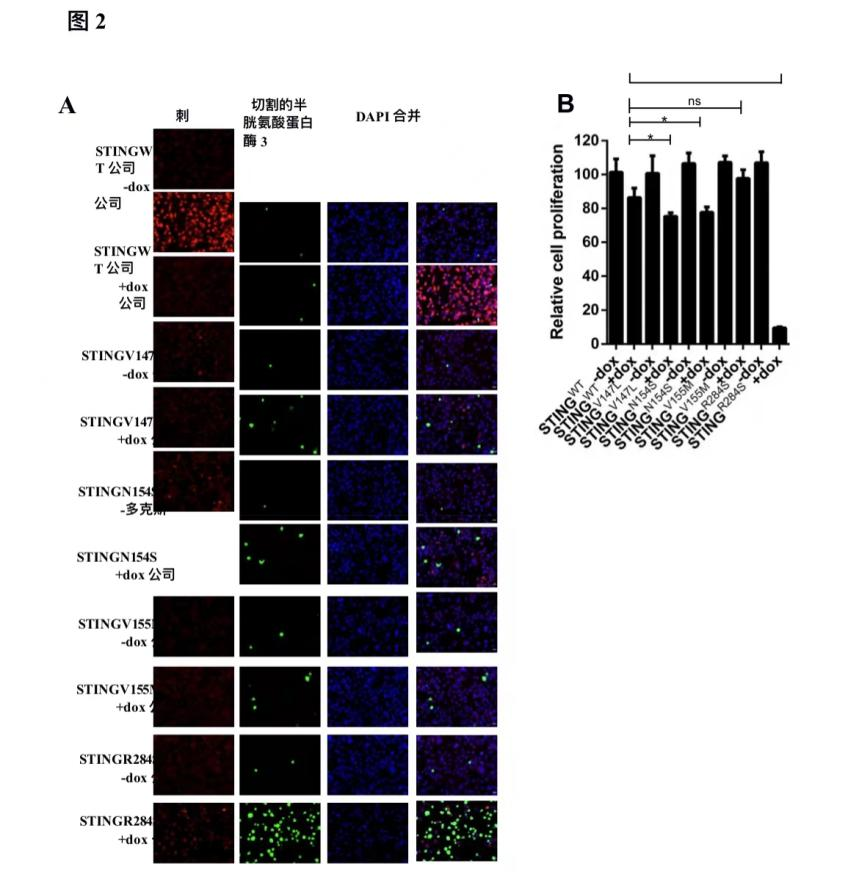
图2:高效STING获得功能突变体的鉴定。(A)稳定表达STING-WT、STING-V147L、STING-N154S、STING-V155M或STING-R284S的MIA PaCa-2细胞用或不用5µg/mL dox处理48小时。对细胞进行STING染色(红色)和切割的Caspase-3染色(绿色)。(B) 稳定表达STING-WT、STING-V147L、STINGN-154S、STING-V155M或STING-R284S的MIA PaCa-2细胞用或不用5µg/mL dox处理。在治疗后96小时,通过滴度GLO 3D细胞活性测定测定细胞活性(ns:无显著性,*P<0.05,**P<0.01,***P<0.001)。
然后,研究着手建立一种新的方法,利用STING获得功能的基因突变,在STING沉默的癌症中重新激活STING信号通路。为了筛选这些STING获得功能突变体抑制肿瘤增殖的能力,构建了稳定表达强力霉素(dox)诱导的野生型(WT)STING的MIA PaCa-2细胞或者是一个毒刺突变体。STING-R284S突变体在MIA PaCa-2细胞中的表达显著增加早期细胞死亡标记物切割caspase-3的表达(图2A),并抑制细胞增殖,可能通过增加经历细胞死亡的细胞数量(图2B)。相反,STINGWT和其他STING攻能获得突变体的表达并没有诱导这种效应。值得注意的是,所有功能突变体的STING增益显示出比WT STING更低的信号(图2A)。
dox处理可有效诱导两种稳定细胞系中的表达(图3A-B、图S1A-B)。与STING-WT相比,dox诱导的STING-R284S刺激STING下游抗肿瘤细胞因子的表达,如CCL5、CXCL10、IL29、IL6、IFNb和TNF(图a3C、图S1C)。此外,与未诱导的细胞和表达dox诱导的STING-WT的细胞相比,STINGR-284S的表达增加了切割的caspase-3的水平(图3A、图S1A),并显著抑制了这些癌细胞的增殖(图3D、图S1D)。


图S1:dox诱导的STING-R284S的异位表达刺激PDAC细胞中关键的抗肿瘤细胞因子的产生和癌细胞死亡。(A-C)稳定表达STING-WT或STING-R284S的BxPC-3细胞用或不用5µg/mL dox处理24小时。(A)对细胞进行STING染色(红色)和切割的Caspase-3染色(绿色)。(B) 通过RT-qPCR证实STING-WT和STING-R284S的表达。(C) 通过RT-qPCR测量所示基因的mRNA水平,并将其标准化为GAPDH mRNA水平。未经处理的STINGWT细胞的值设置为1。(D) 稳定表达STING-WT或STING-R284S的BxPC-3细胞用或不用5µg/mL Dox处理。在治疗后72小时,通过滴度GLO 3D细胞活力测定测定细胞活力。误差条代表三个独立实验的SEM。(ns:不显著,*P<0.05,**P<0.01,***P<0.001)。
病毒载体不能用来携带“热”STINGR284突变体,因为STING信号通路的激活阻止了许多病毒衍生载体的包装。
另一方面,mRNA-LNP已成为在癌细胞中传递基因表达的有力工具,也是强辅助性T细胞1(Th1)偏向的佐剂。作为测试这一策略的第一步,我们生成了编码STING-R284S和STING-WT的mRNAs,并将它们转染到PDAC细胞中。与模拟转染细胞相比,在STING-WT和STING-R284S-mRNA转染的PDAC细胞中检测到强烈的STING表达(图4A-B、图S2A-B)。
然而,只有STING-R284S-mRNA而不是STING-WT-mRNA刺激抗肿瘤细胞因子的产生,如bCCL5、CXCL10、IL29、IL6、IFN和TNF(图4C、图S2C)。此外,与STING-WT-mRNA不同,STING-R284S-mRNA的转染显著提高了切割的caspase-3水平,并显著降低了癌细胞的增殖率(图4A、4D、S2A、S2D)。这些结果表明,转染STING-R284S-mRNA可以特异性地刺激STING信号通路,产生必需的抗肿瘤细胞因子并杀死癌细胞。
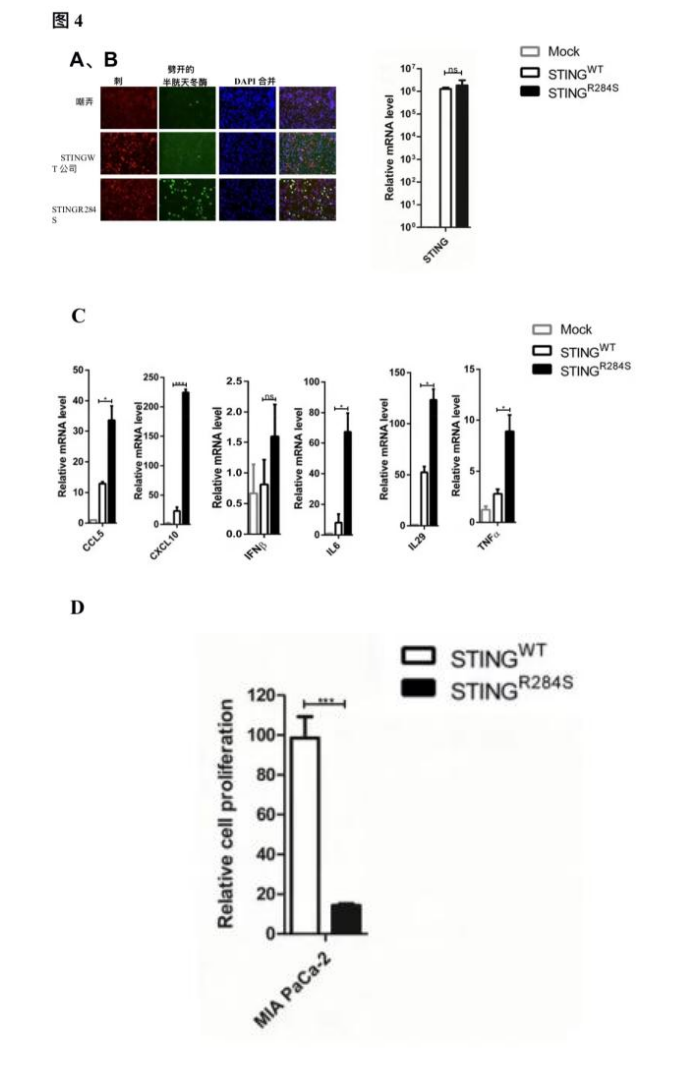
图4:转染STINGR-284S-mRNA可激活重要的抗肿瘤细胞因子的产生并触发PDAC细胞死亡。(A-C)用0.5µg STING-WT或STING-R284S-mRNA转染10e4 MIA PaCa-2细胞。转染后15小时,对细胞进行STING(红色)和切割的Caspase-3(绿色)染色(A),通过RT-qPCR(B)确认STING-WT和STING-R284S的表达,并检测STING-WT和STING-R284S的mRNA水平所示基因通过RT-qPCR进行测量,并标准化为GAPDH mRNA水平(C)。未处理细胞(模拟)的值设置为1。(D) 用1µg STING-WT或STING-R284S-mRNA转染0.5x10e4 MIA PaCa-2细胞。转染后15小时,通过滴度GLO 3D细胞活力测定测定细胞活力。误差条代表三个独立实验的SEM。(ns:不显著,*P<0.05,**P<0.01,***P<0.001)。
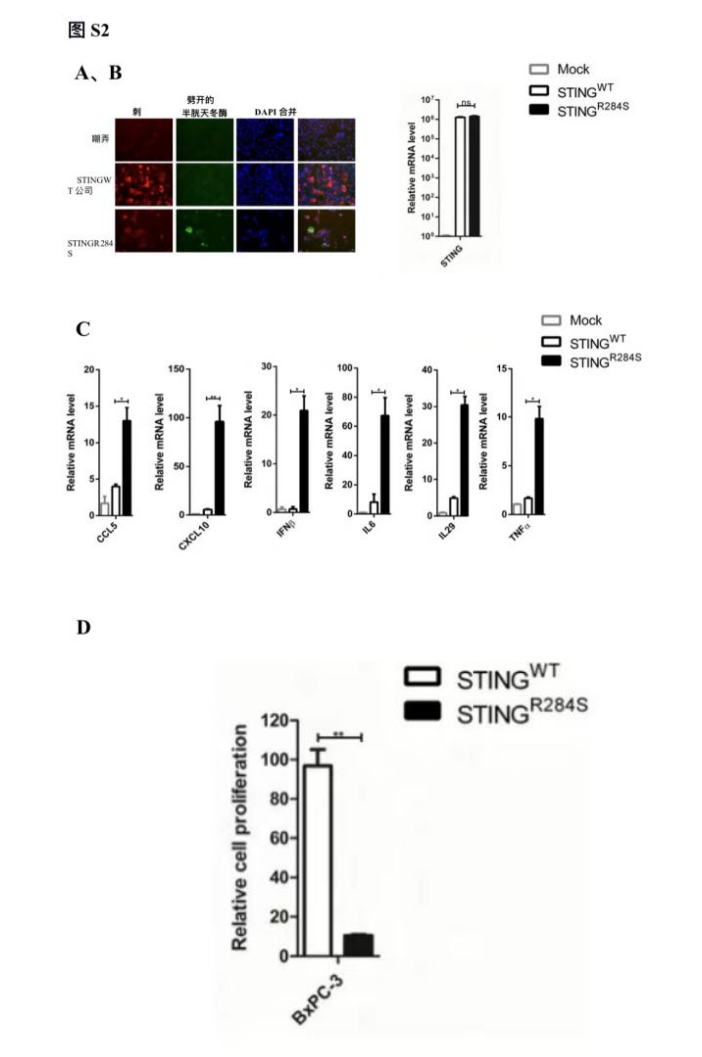
图S2:转染STING-R284S-mRNA可激活重要的抗肿瘤细胞因子的产生并触发PDAC细胞死亡。(A-C)BxPC-3细胞转染,0.5µg STING-WT或STING-R284S-mRNA。转染后15小时,对细胞进行STING(红色)和切割的Caspase-3(绿色)(A)、STINGWT和STING-R284S染色,通过RT-qPCR(B)确认表达,通过RT-qPCR测量所示基因的mRNA水平,并将其标准化为GAPDH mRNA水平(C)。 未处理细胞(模拟)的值设置为1。(D) 用1µg STING-WT或STING-R284S- mRNA转染BxPC-3细胞。转染后15小时,细胞活力为通过滴度GLO 3D细胞活力测定进行测定。误差条代表三个独立实验的SEM。(ns:不显著,*P<0.05,**P<0.01,***P<0.001)。
为了进一步开发一种治疗方法,我们测试了LNP是否可以将STINGR-284S -mRNA传递到癌细胞中。然而,我们没有观察到STING-WT和STING-R284S在分别用mRNA LNP处理的MIA PaCa-2和BxPC-3细胞中的显著表达(图5A和S3A,第2、5行)。我们测试了将STING-WT或STING-R284S -mRNA -LNP与APOE4混合是否能够促进mRNA向PDAC细胞的传递。我们发现,APOE4以剂量依赖性的方式强烈刺激mRNA LNP向PDAC细胞的传递(图5A、图S3A)。与未经处理的细胞相比,在用mRNA LNP和APOE4组合处理的细胞中,通过RT-PCR检测到更高水平的STING-WT和STINGR-284S -mRNA(图5B,图S3B)。与仅使用STING-WT -mRNA的治疗相比,STING-R284S -mRNA LNP和APOE4的联合治疗也显著增强了关键抗肿瘤细胞因子的表达,如CCL5、CXCL10、IL29、IL6和TNF(图5C、图S3C)。
此外,LNP递送的STING-R284S -mRNA不仅诱导PDAC细胞产生裂解的caspase-3,而且还显著抑制这些细胞的增殖(图5A、5D、S3A、S3D)。重要的是,相同的治疗没有抑制CD8+T细胞的增殖(图S3E)。

图5:由mRNA LNP传递的STING-R284S激活必需的抗肿瘤细胞因子的产生并杀死PDAC细胞。(A) 用1µg STING-WT或STING-R284S- mRNA LNP处理2x10e4 MIA PaCa-2细胞,将其与指定浓度的重组人APOE4蛋白预混合。转染后16小时,对细胞进行STING染色(红色)和切割的Caspase-3染色(绿色)。(B-C)10e4 MIA PaCa-2,如(A)所示,使用10µg/ml人APOE4蛋白处理细胞。转染后16小时,通过RT-qPCR(B)确认STINGWT和STINGR284S的表达,并通过RT-qPCR测量所示基因的mRNA水平,并将其标准化为GAPDH mRNA水平(C)。未处理细胞(模拟)的值设置为1。(D) 0.5x10e4 MIA-PaCa-2细胞按(B)处理。转染后16小时,通过滴度GLO 3D细胞活力测定测定细胞活力。误差条代表三个独立实验的SEM。(ns:不显著,*P<0.05,**P<0.01,***P<0.001)。

图S3:由mRNA LNP传递的STINGR284S激活必需的抗肿瘤细胞因子的产生并杀死PDAC细胞。(A) 10e4 BxPC-3细胞用1µg STING-WT或STING-R284S-mRNA LNP,与指定浓度的重组人APOE4蛋白预混合。转染后16h,细胞对STING(红色)和切割的Caspase-3(绿色)进行染色。(B-C)用1µg STING-WT或STING-R284S- mRNA- LNP处理10e4 BxPC-3细胞,这些LNP与10µg/ml人APOE4蛋白预混合。转染后16h,通过RT-qPCR(B)证实STING-WT和STING-R284S的表达,并且所示基因通过RT-qPCR进行测量,并标准化为GAPDH mRNA水平(C)。未处理细胞(模拟)的值设置为1。(D) 用1µg STING-WT或STING-R284S-mRNA-LNP处理0.5x10e4 BxPC-3细胞,其与10µg/ml APOE4蛋白。转染后16h,通过滴度GLO 3D细胞活力测定测定细胞活力。(E) 10e4 CD8+T细胞用1µg STING-WT或STING-R284S mRNA LNP处理,其与10µg/ml APOE4蛋白预混合。转染后16h,通过滴度GLO 3D细胞活力测定测定细胞活力。误差条代表三个独立实验的SEM。(ns:不显著,*P<0.05,**P<0.01,***P<0.001)。
我们之前的研究表明,STING在MCPyV+MCC细胞系中受到特异性抑制。通过分析已发表的RNA序列数据,我们发现在MCPyV-MCC细胞系UISO中表达,在所有六种经典MCPyV+MCC细胞系中几乎检测不到STING RNA表达水平:MKL-1、MKL-2、MS-1、WaGa、PeTa和BroLi(图S4A)。RNA-seq数据还表明,与其他MCPyV+MCC细胞系相比,PeTa细胞中STING RNA的表达略高(图S4A)。然而,Western blot分析显示,与MKL-1细胞类似,PeTa细胞中的STING蛋白表达完全不易察觉(图S4B)。因此,这项研究证实,在我们检测的所有经典MCPyV+MCC细胞系中,STING表达均受到抑制。

图S4:STING在经典的MCPyV+MCC细胞系中沉默。(A) 根据公布的RNA-seq数据计算MKL-1、MKL-2、MS-1、WaGa、PeTa、BroLi和UISO细胞中STING的mRNA水平(HTseq计数)[87]。误差条代表三个独立实验的SEM。(ns:不显著,*P<0.05,**P<0.01,***P<0.001),(B) 使用指定抗体对PeTa、MS-1、UISO、MCC13和原代HDF细胞的全细胞裂解物进行免疫印迹。GAPDH用作加载控制。

在PDAC细胞中观察到的STING-R284S-mRNA-LNP的抗肿瘤活性的鼓舞下,我们测试了我们的LNP方法是否可以用于刺激MCC细胞也有同样的阳性反应。我们首先使用萤火虫荧光素酶mRNA LNP优化MCC细胞的mRNA LNP输送条件。我们确定10 ug/ml的人载脂蛋白E4也是将mRNA LNP导入MCC细胞的理想浓度(图S5)。
与未经处理的MKL-1和MS-1 MCC细胞相比,STING-WT和STING-R284S- mRNA- LNP处理的细胞中均检测到强烈的STING表达(图6A-B、S6A-B)。然而,只有STING-R284S-mRNA-LNP的输送,而不是STING-WT-mRNA-LNP的输送,刺激关键抗肿瘤细胞因子CCL5、CXCL10、IL29、IL6、IFN和TNF的b表达(图6C、S6C)。与STING-WT相比mRNA-LNP,用STING-R284S-mRNA-LNP处理MCC细胞,也提高了切割的caspase-3水平,并大大抑制了细胞增殖(图6A、6D、S6A、S6D)。这些结果表明,STING-R284S-mRNA-LNP也能诱导受试MCC细胞系的抗肿瘤细胞因子表达和细胞死亡。

图6:STINGR-284S-mRNA-LNP可触发MCC细胞中重要的抗肿瘤细胞因子的产生和细胞死亡。(A) 用1µg STING-WT或STING-R284S-mRNA-LNP处理10e4 MKL-1细胞,将其与指定浓度的重组人APOE4蛋白预混合。转染后16h,对细胞进行STING染色(红色)和切割的Caspase-3染色(绿色)。(B-C)10e4 MKL-1细胞被处理为在(A)中,使用10µg/ml人APOE4蛋白。转染后16小时,通过RT-qPCR(B)确认STING-WT和STING-R284S的表达,并通过RT-qPCR测量所示基因的mRNA水平,并将其标准化为GAPDH mRNA水平(C)。未处理细胞(模拟)的值设置为1。(D) 0.5x10e4 MKL-1电池,在转染后40小时,通过滴度GLO 3D细胞活力测定测定细胞活力。误差条代表三个独立实验的SEM。(ns:不显著,*P<0.05,**P<0.01,***P<0.001)。

图S6:STING-R284S-mRNA-LNP可触发MCC细胞中重要的抗肿瘤细胞因子的产生和细胞死亡。(A) 用1µg STING-WT或STING-R284S-mRNA-LNP处理10e4 MS-1细胞,将其与指定浓度的重组人APOE4蛋白预混合。转染后16h,对细胞进行STING染色(红色)和切割的Caspase-3染色(绿色)。(B-C)10e4 MS-1细胞用1µg STINGWT或STING-R284S-mRNA-LNP,与10µg/ml人APOE4蛋白预混合。转染后16h,STING-WT和STING-R284S表达增加通过RT-qPCR确认(B),并通过RT-qPCR测量所示基因的mRNA水平,并将其标准化为GAPDH mRNA水平(C)。未处理细胞(模拟)的值设置为1。(D) 用1µg STING-WT或STING-R284S-mRNA-LNP处理0.5x10e4 MS-1细胞,并在0小时和24小时与10µg/ml APOE4蛋白预混合。转染后40h,通过滴度测定细胞活力-GLO 3D细胞活性测定。误差条代表三个独立实验的SEM。(ns:不显著,*P<0.05,**P<0.01,***P<0.001)。
综上所述,我们证明STINGR-284S-mRNA-LNP强烈激活癌细胞中的STING信号通路,从而产生关键的抗肿瘤药物细胞因子和癌细胞死亡。
03
结 论
为了克服传统的STING激动剂在STING沉默的癌症中不起作用的局限性,我们探索了在STING沉默的免疫“冷”PDAC中引入天然存在的组成性活性获得功能STING突变体以重新激活抗肿瘤免疫的想法。
结果表明,STINGR-284S -mRNA -LNP可以克服传统STING激动剂的毒性和局限性,因此可以作为一种新的治疗方法,用于治疗一系列对当前治疗无效的STING缺陷型癌症。