
简介
mRNA疗法是一种新型的基因疗法,合成mRNA为任何给定蛋白质、蛋白质片段或肽的合成提供模板,并有助于广泛的药物应用,包括癌症免疫治疗的不同模式。
刺激模式识别受体从而产生抗病毒型先天免疫反应的能力使基于mRNA的疫苗具备了固有的佐剂性。核苷修饰和消除双链RNA可以降低mRNA的免疫调节活性,增加和延长蛋白质的产生。与提高转染效率和促进淋巴系统靶向性的基于纳米颗粒的制剂相结合,核苷修饰的mRNA能够有效递送细胞因子、共刺激受体或治疗性抗体。与相应的重组蛋白相比,生物活性分子可以改善药代动力学、药效学和安全性。
本文强调了基于mRNA的癌症治疗领域的进展,为关键的临床前发展和不断发展的临床前景提供了见解。
结果与讨论
在过去的30年里,人们做出了大量努力来提高细胞内的稳定性、翻译效率和mRNA的摄取。这些优化是通过修改其非编码元素(5′cap结构及其封盖效率、5′-和3′-未翻译)实现的区域(UTR),3′聚(A)尾)和编码区,并通过转染和配方技术的发展(图1)。
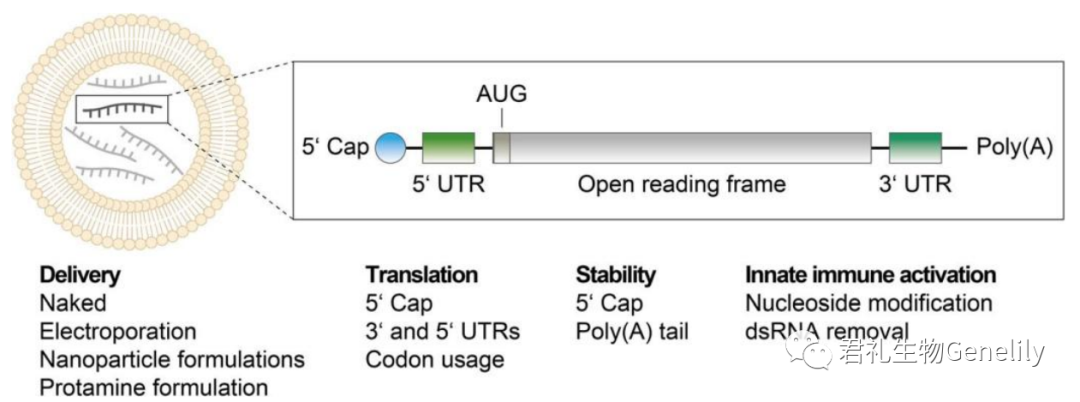
图1:mRNA疗法的递送和结构元件。脂质基mRNA纳米粒(左)和合成mRNA(右)的结构,包括5′cap、5′和3′UTR、启动开放阅读框(AUG)的起始密码子和聚(a)尾。列出了不同的mRNA递送方法,以及影响mRNA翻译、稳定性和先天性免疫激活潜力的可调结构元件。UTR:非翻译区;ds:双绞线
在这些进展的基础上,合成mRNA已成为一种多功能的遗传信息传递系统,用于诱导细胞产生肽和蛋白质。
合成的mRNA为单链(ss),包含一个5′端帽、包含编码区的UTR和一个3′多聚体(a)尾巴。mRNA不会进入细胞核,也不会整合到基因组中,翻译发生在细胞质中,来自合成mRNA的蛋白质与来自内源性mRNA的蛋白质无法区分。蛋白质经过翻译后修饰,并通过靶向序列或跨膜结构域进入亚细胞区,如分泌途径、细胞膜、细胞核、线粒体或过氧化物酶体。最终,蛋白质被降解,pep-肽出现在主要的组织相容性(MHC)复合物上。
在癌症免疫治疗中,mRNA最先进的应用是治疗性疫苗接种,它提高了mRNA传递遗传信息的能力及其固有的免疫刺激活性。然而,IFN刺激的基因(ISG),如IFN诱导的双链(ds)RNA激活的蛋白激酶(PKR)和2′,5′-寡腺苷酸合成酶(OAS)以及随后的RNA酶L表达,启动了抗病毒防御状态,其特征是mRNA翻译停滞和mRNA降解靶向性增加。
mRNA在癌症免疫治疗中的其他应用包括T细胞和自然杀伤(NK)细胞与抗原受体的工程及其应用作为多种免疫和非免疫细胞中免疫活性蛋白质的模板(图2)。
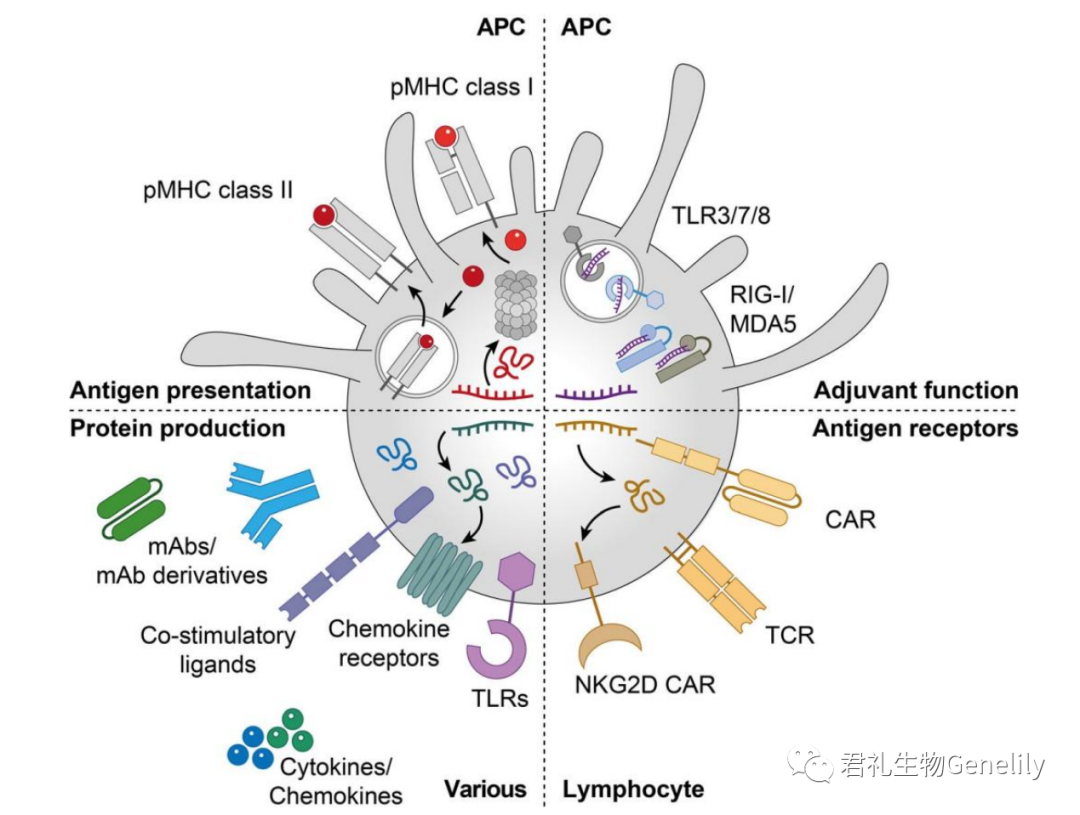
图2:肿瘤免疫治疗中的mRNA疗法。mRNA用于抗癌疫苗接种,它将癌症抗原输送至APC,在MHC I类和II类(左上)上呈现,并通过结合APC表达的PRR(右上)刺激先天性免疫激活,将抗原受体(如CARs和TCR)引入淋巴细胞(右下),并允许表达包括TLR在内的免疫调节蛋白,不同细胞亚群中的趋化因子受体、共刺激配体、细胞因子、趋化因子和不同形式的单克隆抗体(左下)。抗原提呈细胞;CAR:嵌合抗原受体;单克隆抗体:单克隆抗体;MDA5:黑色素瘤分化相关蛋白5;pMHC:肽主要组织相容性复合物;NKG2D:自然杀手组2D;模式识别受体;RIG-I:维甲酸诱导基因1;TCR:T细胞受体;TLR:Toll样受体
癌症疫苗接种包括诱导肿瘤特异性T细胞反应,通过在免疫刺激的情况下提供肿瘤抗原,潜在地能够进行肿瘤再注射。mRNA疫苗编码TSA或TAA的全部或部分序列,不依赖于事先确定患者的人类白细胞抗原(HLA)单倍型或表位预测。
表1提供了使用mRNA疫苗进行的所有现行、已完成或终止的II期和III期临床试验的总结。
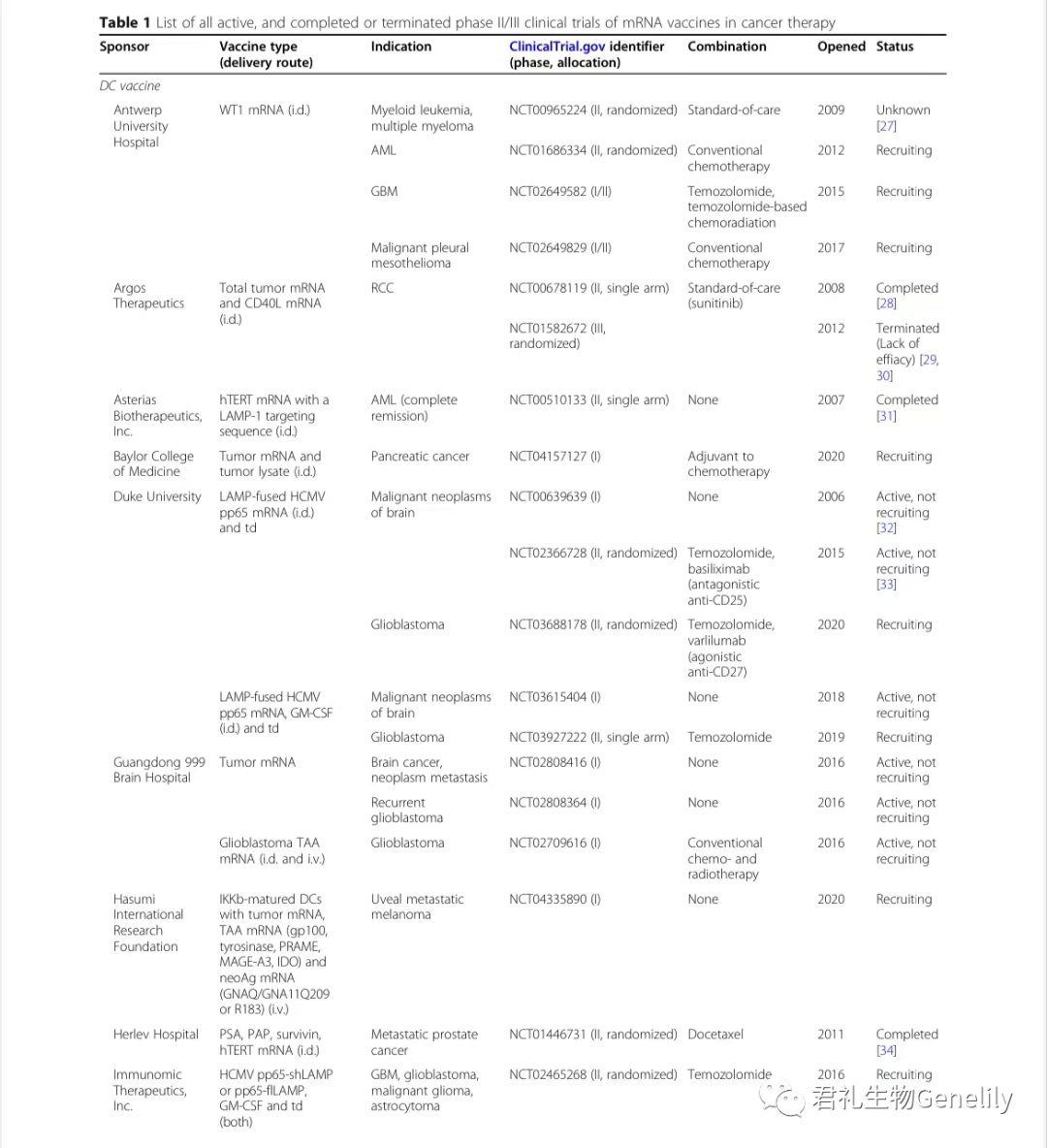
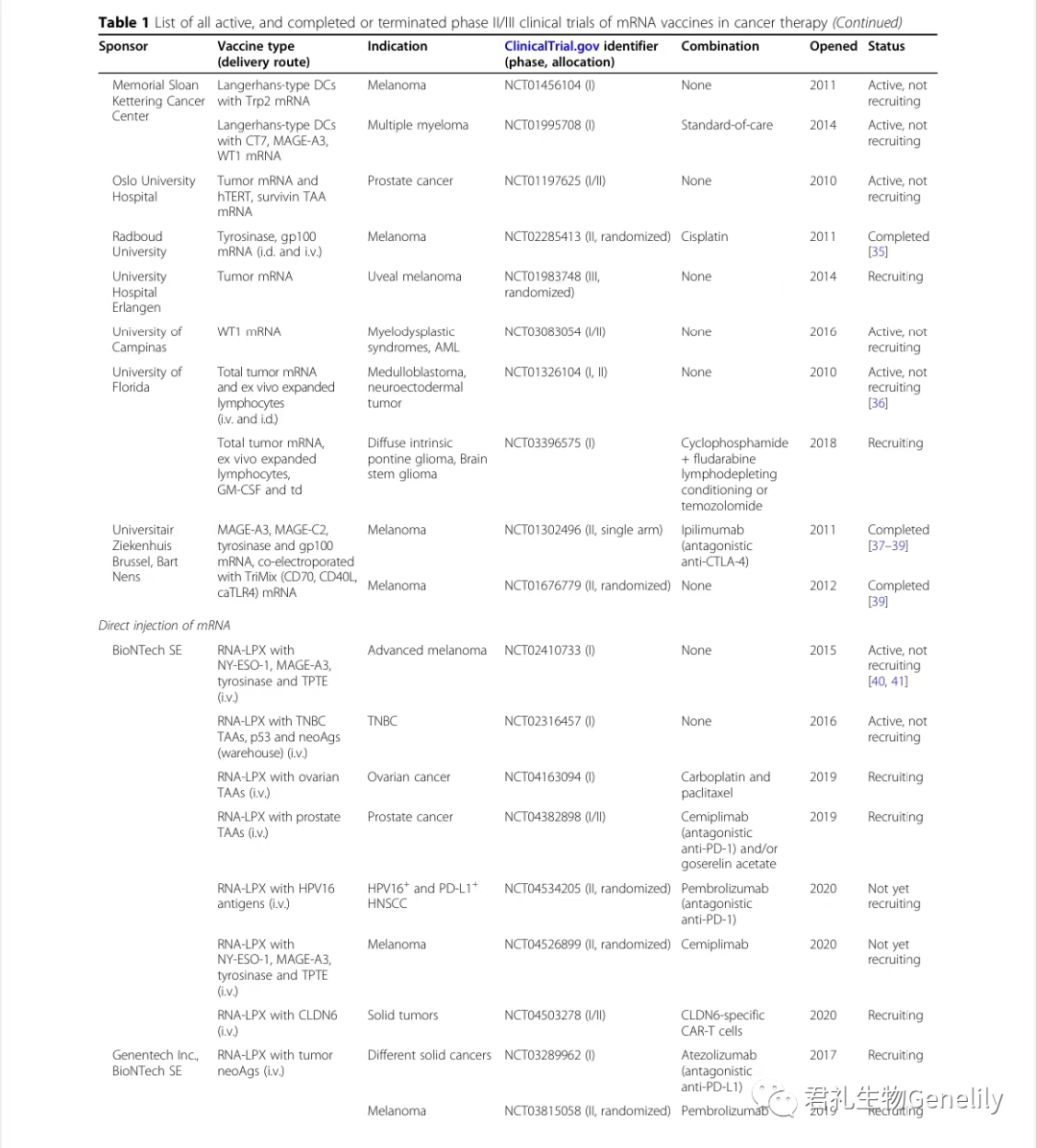
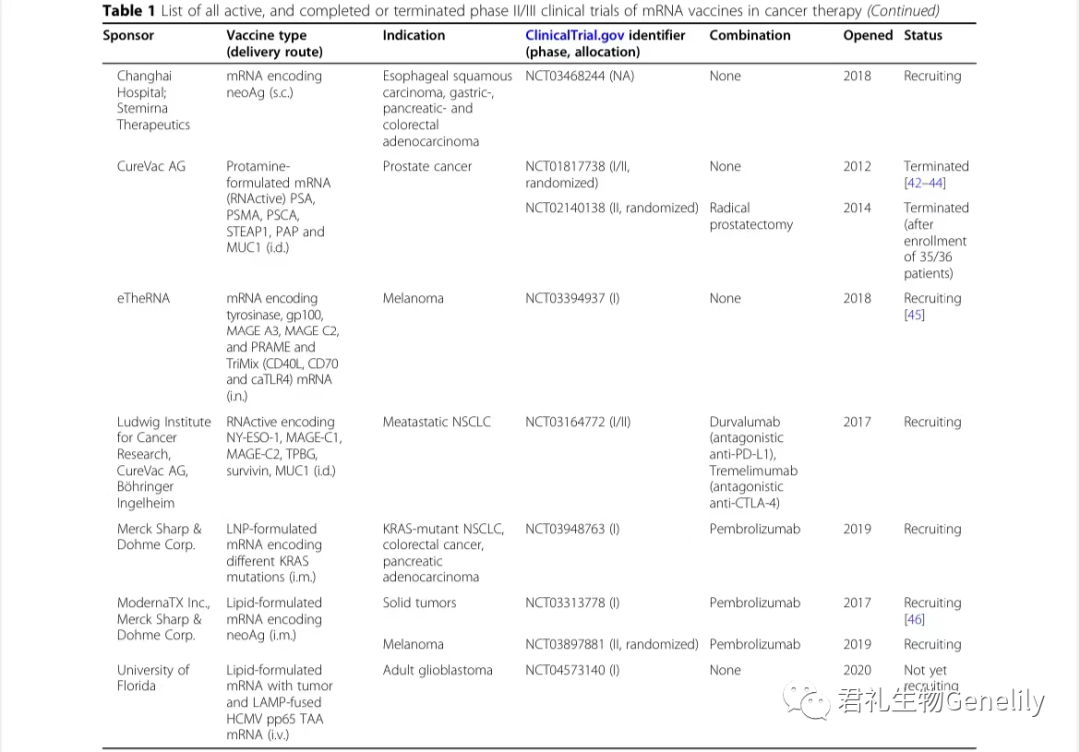
表1:来自临床试验。gov(关键词:癌症、mRNA、疫苗)于2020年11月1日发布,PubMed文献检索。
用mRNA编码肿瘤抗原的脉冲DC的方法之一是使用从自体肿瘤中提取的大量mRNA。由mRNA负载的DC疫苗诱导的T细胞反应相当弱,这可能是导致临床疗效低下的原因。DC分化、成熟和抗原负载直接影响DC归巢和T细胞共刺激,是进一步改进该方法的目标。
同源T细胞帮助是决定疫苗诱导T细胞应答程度的关键因素。这要求疫苗抗原呈现在DC的MHC II类分子上。转染DC的mRNA进行细胞质翻译,进入内源性处理室,因此呈现在MHC I类分子上,而不是MHC II类分子上。通过将抗原穿过溶酶体区,如将疫苗抗原融合到溶酶体相关膜蛋白(LAMP),或融合到MHC I类细胞胞浆和跨膜结构域,已经遵循了几种策略来增强MHC II类抗原呈递。当ssRNA和dsRNA触发TLR激活时,带有mRNA的DC脉冲提供了一个成熟信号。
癌症的另一种免疫治疗方法是通过稳定的免疫系统将T细胞重新定向到肿瘤细胞上整合肿瘤特异性抗原受体,或与T细胞受体(TCR)结合,TCR识别来自细胞内和细胞外抗原的MHC呈现的表位,或与肿瘤表面抗原结合且不依赖MHC的CAR结合,然后在细胞培养系统中扩增T细胞。
mRNA电穿孔导致CAR在T细胞表面表达约7天,而在靶细胞计数器上内化的CAR不会恢复。CAR结构的分子结构(例如,共刺激do-mains)可能会影响表达水平和持续时间。尽管CAR表达的水平和持续性与杀伤效力呈正相关,但体外研究表明,高CAR表达有利于激活诱导的细胞死亡(AICD),高量的mRNA输入可影响生存能力。
早期研究表明,mRNA转染的T细胞能有效地裂解抗原表达的肿瘤细胞,TCR对NY-ESO-1、MART-1或p53具有特异性,CAR针对CD19。体内抗肿瘤效应的第一个证据来自在卵巢癌异种移植模型中转染了编码HER-2/neu特异性CAR mRNA的PBL。临床I期研究探索了针对各种抗原的mRNA CAR-T细胞(表2)。
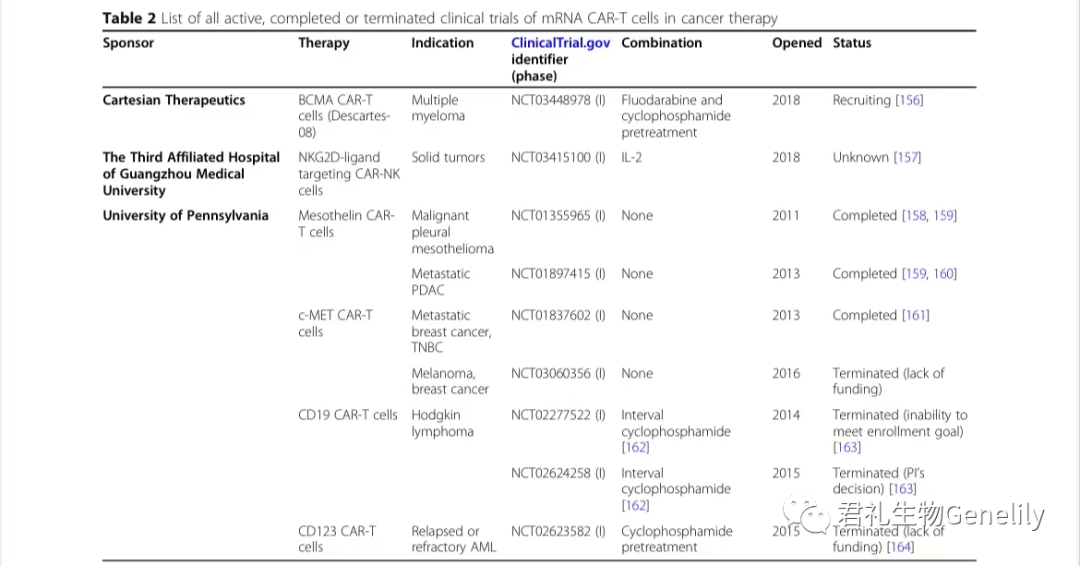
表2:来自临床试验。gov(关键词:癌症、mRNA、CAR)于2020年11月1日发布,PubMed文献研究。
mRNA还被用于传递完整的IgG单克隆抗体或支架,包括工程化的双特异性抗体片段,并解决药代动力学(如短半衰期、快速清除)以及制造挑战(如聚集体),以加速临床开发。
单克隆抗体是一种公认的癌症治疗方法,用于靶向肿瘤细胞和调节免疫细胞反应。大多数经ap证实的重组单克隆抗体是通过静脉注射来实现全身暴露的。与通过静脉注射介导的全身暴露相比,通过直接注射到特定组织或通过体外转染特定细胞类型的局部mRNA翻译限制了翻译蛋白对靶细胞或其介导环境的治疗活性。
在没有抗原特异性免疫的情况下,过继转移携带编码激动性抗GITR单抗mRNA的体外转染DC可延迟小鼠肿瘤生长,其效果与静脉注射大量(1 mg)重组抗GITR单抗的效果相当。用编码激动性抗GITR单抗或可溶性GITRL-Fc融合蛋白、特异性抗CTLA-4单抗和Trp-2 mRNA的mRNA共转染DC,进一步扩展了这种方法。
这一概念后来被取消-在一项小型试验中,包括两名转移性黑色素瘤患者(表3)。
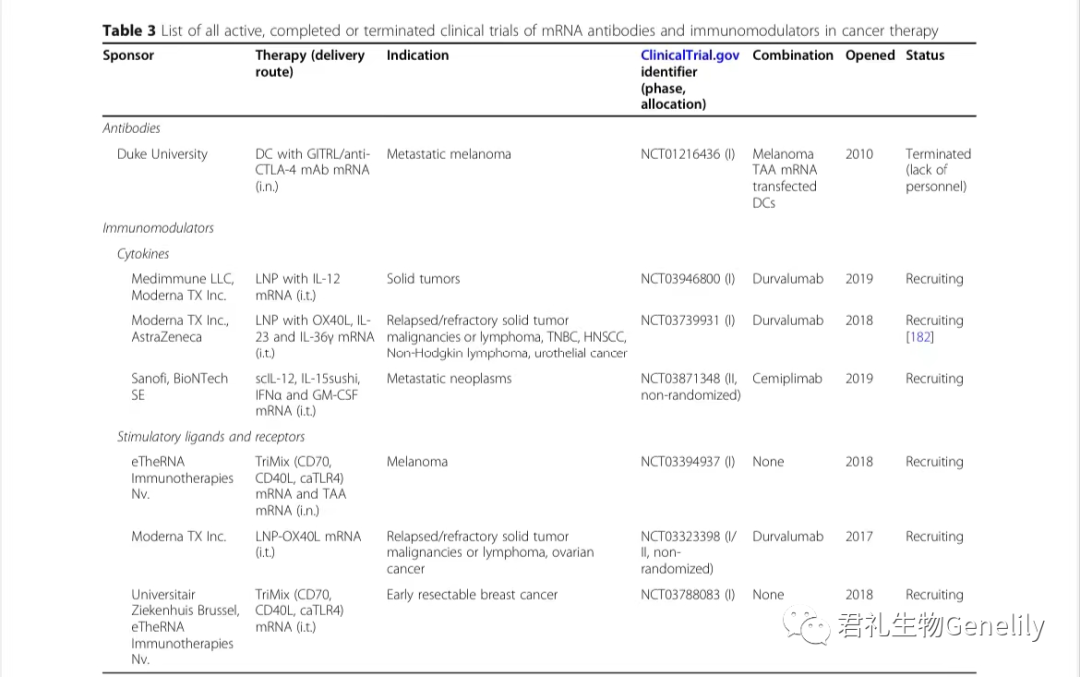
表3:来自临床试验。gov(关键词:癌症和mRNA及免疫调节剂或细胞因子或共刺激物或抗体)于2020年12月1日发布,PubMed文献检索。
迄今为止研究的mRNA编码的免疫调节剂包括细胞因子以及共刺激配体和受体(临床开发中的配体和受体见表3)。
当使用mRNA在体内产生免疫调节剂时,需要高蛋白质产量。大多数依赖于体内或肿瘤内给药的mRNA翻译的研究使用了核苷修饰的mRNA,而涉及体外转染靶细胞的方法并没有试图减弱mRNA固有的免疫刺激活性。
重组T细胞刺激细胞因子是一种经过临床前验证的治疗概念,其临床发展受到严重毒性的阻碍。
重组IL-2的主要局限性在于其对Treg扩增的优先刺激和较短的血清半衰期,需要高频率的dos,这反过来会加剧不良反应。IL-15在功能上与IL-2相关,通过IL-2Rβ和普通γ链(IL-2Rβγ)发出信号,从而刺激T细胞和NK细胞。而IL-2对Treg的发育和内环境稳定至关重要,并支持AICD控制自身反应T细胞、IL-15延长CD8+记忆的存活时间T细胞。IL-12是TH1免疫的有效介质,在小鼠肿瘤模型中具有显著的抗肿瘤活性。
在人类中,IL-12与全身给药后的潜在致命毒性有关。各种mRNAs可以很容易地混合在一起,形成单一的药物产品,这一技术特性鼓励了联合疗法的发展。
瘤内注射LNP-N1-甲基假尿苷修饰的mRNAs编码IL-36γ(一种作为警报蛋白的促炎细胞因子)、IL-23(一种炎症调节因子)和OX40L证明了三种同基因肿瘤模型中已建立肿瘤的回归。三联mRNA治疗后,肿瘤微环境(TME)中的炎性细胞因子和趋化因子以及多种DC和T细胞类型的募集和激活增加。在使用单一mRNA结构的组合方法中,IFNβ与转化生长因子(TGF)β受体II的外结构域融合,以刺激先天免疫,同时对抗TGFβ的抑制功能。刺激性配体和受体的相互作用为免疫系统提供炎症信号,可用于癌症免疫治疗。
结论
在新冠病毒发生后不到1年内研发并在全球范围内批准或授权抗SARS-CoV-2 mRNA疫苗-19大流行展示了mRNA技术的巨大潜力。
2019冠状病毒疾病mRNA疫苗发展迅速,具有良好的安全性,优于现有技术,预防2019冠状病毒疾病的有效率约为95%。mRNA技术的美妙之处在于其多功能性的宽频带。
通过修改合成mRNA的构建块、结构元素和配方,包括靶向可以适应特定的细胞、表达持续时间和免疫效果。这将mRNA的设计空间扩展到治疗性癌症疫苗之外。mRNA现在被用于最多样化的免疫治疗方法,包括为免疫细胞配备抗原受体和体内生产治疗性蛋白质,如抗体或免疫调节剂。
随着越来越多的概念进入临床试验,第一个针对癌症的mRNA治疗的批准即将到来。